2×Pfu PCR 믹스
활동 정의
1단위(U) Pfu DNA 중합효소의 활성은 활성 연어 정자 DNA를 주형/프라이머로 사용하여 74°C에서 30분 이내에 산 불용성 물질에 10 nmol 데옥시뉴클레오티드를 통합하는 데 필요한 효소의 양으로 정의됩니다.
품질 관리
SDS-PAGE 검출에 의한 순도는 99% 이상입니다. 외인성 뉴클레아제의 활성은 감지되지 않습니다. 인간 게놈의 단일 복제 유전자는 효과적으로 증폭될 수 있습니다. 1주일 동안 실온에서 보관할 때 유의미한 활성 변화가 없습니다.
주요 기술적인 모수
3'-5' 엑소뉴클레아제 활성이 있고 5'-3' 엑소뉴클레아제 활성이 없습니다. DNA 증폭의 확장 속도는 Taq 중합 효소의 확장 속도보다 느리고 일반적으로 Pfu 효소의 확장 속도는 분당 0.5-1kb입니다. Pfu의 열 안정성은 Taq보다 우수합니다. GC 함량이 높은 템플릿의 경우 변성 온도를 98°C까지 높일 수 있으며 이는 Pfu 중합효소의 활성에 영향을 미치지 않습니다. PCR 산물은 blunt-ended이며, TA 벡터로 결찰하거나 blunt-ended 벡터로 클로닝하기 전에 3'-dA 돌출부를 추가할 수 있습니다.
애플리케이션
유전자 발현 클로닝, 부위 지정 돌연변이, 단일 염기 다형성(SNP) 분석 및 말단 복구와 같은 DNA의 고충실도 증폭에 사용할 수 있습니다.
모든 제품은 ODM/OEM용으로 사용자 정의할 수 있습니다. 자세한 내용은맞춤형 서비스(ODM/OEM)를 클릭하십시오.
 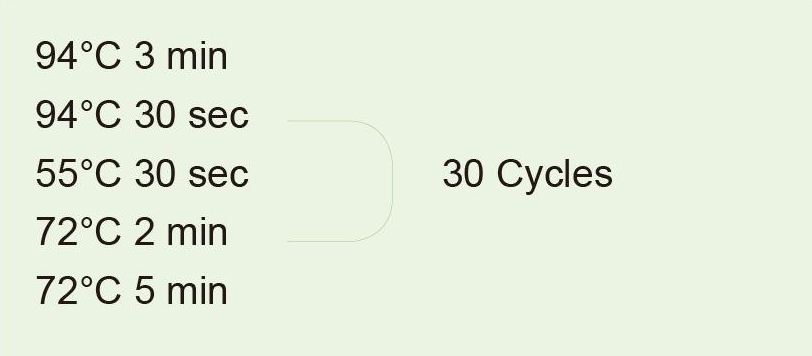 |
genomic DNA를 주형으로 사용하여 1kb 조각을 증폭합니다. PCR 반응 후 전기영동 검출을 위해 5㎕를 취한다. |
A-1 템플릿
■ template에는 protein 불순물이나 Taq inhibitor 등이 포함되어 있습니다. ——DNA template를 정제하거나, protein 불순물을 제거하거나, 정제 키트를 이용하여 template DNA를 추출합니다.
■ Template의 denaturation이 완료되지 않은 경우 ——denaturation 온도를 적절히 높이고 denaturation 시간을 연장합니다.
■ 템플릿 저하 — 템플릿을 다시 준비합니다.
A-2 프라이머
■ 프라이머 품질 불량 ——프라이머를 재합성합니다.
■ 프라이머 분해 ——보존을 위해 고농도 프라이머를 소량으로 분취합니다. 다중 냉동 및 해동을 피하거나 장기간 4°C 동결 보존하십시오.
■ 부적절한 프라이머 디자인(예: 프라이머 길이 부족, 프라이머 사이에 이합체 형성 등) - 프라이머 재설계(프라이머 이량체 및 이차 구조 형성 방지)
A-3 MG2+집중
■ 마그네슘2+ 농도가 너무 낮습니다 —— Mg를 적절히 증가시킵니다.2+ 농도: Mg 최적화2+ 최적의 Mg를 결정하기 위해 0.5mM 간격으로 1mM에서 3mM까지의 일련의 반응에 의한 농도2+ 각 템플릿 및 프라이머에 대한 농도.
A-4 소둔 온도
■ 높은 Annealing 온도는 Primer와 Template의 결합에 영향을 미칩니다. ——어닐링 온도를 낮추고 2°C의 기울기로 조건을 최적화합니다.
A-5 연장시간
■ 짧은 연장 시간 - - 연장 시간을 늘립니다.
현상: 음성 샘플은 또한 표적 서열 밴드를 보여줍니다.
A-1 PCR의 오염
■ 표적 염기서열 또는 증폭 산물의 교차 오염 ——음성 검체에 표적 염기서열이 포함된 검체를 피펫팅하거나 원심분리기 튜브 밖으로 흘리지 않도록 주의하십시오. 시약 또는 장비는 기존 핵산을 제거하기 위해 고압멸균 처리해야 하며, 음성 대조군 실험을 통해 오염 여부를 확인해야 합니다.
■ 시약 오염 ——시약을 분취하여 저온에서 보관합니다.
A-2 프라임r
■ 마그네슘2+ 농도가 너무 낮습니다 —— Mg를 적절히 증가시킵니다.2+ 농도: Mg 최적화2+ 최적의 Mg를 결정하기 위해 0.5mM 간격으로 1mM에서 3mM까지의 일련의 반응에 의한 농도2+ 각 템플릿 및 프라이머에 대한 농도.
■ 프라이머 디자인이 부적절하고 target sequence가 non-target sequence와 상동성을 갖는다. ——프라이머를 다시 디자인합니다.
현상: PCR 증폭 밴드가 예상 크기와 일치하지 않거나 크거나 작거나 때로는 특정 증폭 밴드와 비특이적 증폭 밴드가 모두 발생합니다.
A-1 프라이머
■ 프라이머 특이성 불량
—— 프라이머를 다시 디자인하십시오.
■ 프라이머 농도가 너무 높음 ——denaturation 온도를 적절하게 높이고 denaturation 시간을 연장합니다.
A-2 마그네슘2+ 집중
■ 마그네슘2+ 농도가 너무 높음 ——Mg2+ 농도를 적절하게 감소: Mg 최적화2+ 최적의 Mg를 결정하기 위해 0.5mM 간격으로 1mM에서 3mM까지의 일련의 반응에 의한 농도2+ 각 템플릿 및 프라이머에 대한 농도.
A-3 열안정성 중합효소
■ 과량의 효소량 ——효소량을 0.5U 간격으로 적절하게 줄인다.
A-4 소둔 온도
■ 어닐링 온도가 너무 낮음 ——어닐링 온도를 적절하게 높이거나 2단계 어닐링 방식을 채택합니다.
A-5 PCR 주기
■ PCR 주기가 너무 많음 ——PCR 주기 수를 줄입니다.
A-1 프라이머——불량한 특이성 ——프라이머를 다시 디자인하고 프라이머의 위치와 길이를 변경하여 특이성을 향상시킵니다. 또는 중첩 PCR을 수행합니다.
A-2 템플릿 DNA
——주형이 순수하지 않음 ——주형을 정제하거나 정제 키트로 DNA를 추출합니다.
A-3 MG2+ 집중
——마그네슘2+ 농도가 너무 높음 —— Mg를 적절히 감소2+ 농도: Mg 최적화2+ 최적의 Mg를 결정하기 위해 0.5mM 간격으로 1mM에서 3mM까지의 일련의 반응에 의한 농도2+ 각 템플릿 및 프라이머에 대한 농도.
A-4 dNTP
——dNTP의 농도가 너무 높음 ——dNTP의 농도를 적절하게 줄입니다.
A-5 소둔 온도
——너무 낮은 어닐링 온도 ——어닐링 온도를 적절하게 높입니다.
A-6 사이클
——주기가 너무 많음 ——주기 수 최적화

첫 번째 단계는 적절한 중합효소를 선택하는 것입니다. 일반 Taq 중합효소는 3'-5' 엑소뉴클레아제 활성이 부족하여 교정할 수 없으며 불일치로 인해 단편의 확장 효율이 크게 저하됩니다. 따라서 일반 Taq 중합효소는 5kb보다 큰 표적 단편을 효과적으로 증폭할 수 없습니다. 확장 효율을 개선하고 긴 단편 증폭의 요구 사항을 충족하려면 특수 변형된 Taq 중합효소 또는 기타 고충실도 중합효소를 선택해야 합니다. 또한 긴 단편을 증폭하려면 프라이머 디자인, 변성 시간, 연장 시간, 완충액 pH 등의 상응하는 조정이 필요합니다. 일반적으로 18-24bp의 프라이머가 더 나은 수율로 이어질 수 있습니다. Template 손상을 방지하기 위해 94°C에서 denaturation 시간을 주기당 30초 이하로 줄여야 하며, 증폭 전 온도가 94°C까지 상승하는 시간은 1분 미만이어야 합니다. 또한 extension 온도를 약 68°C로 설정하고 1kb/min의 속도로 확장 시간을 설계하면 긴 조각의 효과적인 증폭을 보장할 수 있습니다.
다양한 DNA 중합효소를 high fidelity로 사용하여 PCR 증폭의 오류율을 줄일 수 있습니다. 지금까지 발견된 모든 Taq DNA 중합효소 중 Pfu 효소가 가장 낮은 error rate와 가장 높은 fidelity를 가지고 있습니다(첨부표 참조). 효소 선택 외에도 연구자들은 완충액 조성 최적화, 열안정성 중합효소 농도 및 PCR 주기 최적화 등 반응 조건을 최적화하여 PCR 돌연변이율을 더욱 낮출 수 있습니다.
제품 카테고리
왜 우리를 선택 했습니까
저희 공장은 설립 이래
품질 우선. 당사의 제품은 업계에서 우수한 평판을 얻었으며 신규 및 기존 고객 사이에서 가치 있는 신뢰를 얻었습니다.








