FastKing gDNA Dispelling RT SuperMix
특징
■ Fast: 템플릿만 추가하면 18분 이내에 게놈 제거 및 효율적인 역전사를 완료하는 원스텝.
■ 고효율: 역전사효소가 소수성 모티브로 변형되어 RT 효율이 95%를 초과합니다.
■ 간편하고 간편함: 독점적인 감열성 DNase는 효과가 빠르고 반응 시간이 짧고 효율이 높으며 cDNA에 영향을 미치지 않습니다.
사양
유형: 유전자 변형 역전사효소, gDNase
절차: 원스텝(genomic DNA 제거 및 RT)
실시간 효율성: >95%
주형: 1ng-2μg
가동 시간: ~18분
신청: 역전사된 cDNA는 기존 PCR, Real time PCR, cDNA 라이브러리 구축, SAGE(Serial Analysis of Gene Expression), 프라이머 확장 및 기타 기존 실험에 사용할 수 있습니다.
모든 제품은 ODM/OEM용으로 사용자 정의할 수 있습니다. 자세한 내용은맞춤형 서비스(ODM/OEM)를 클릭하십시오.
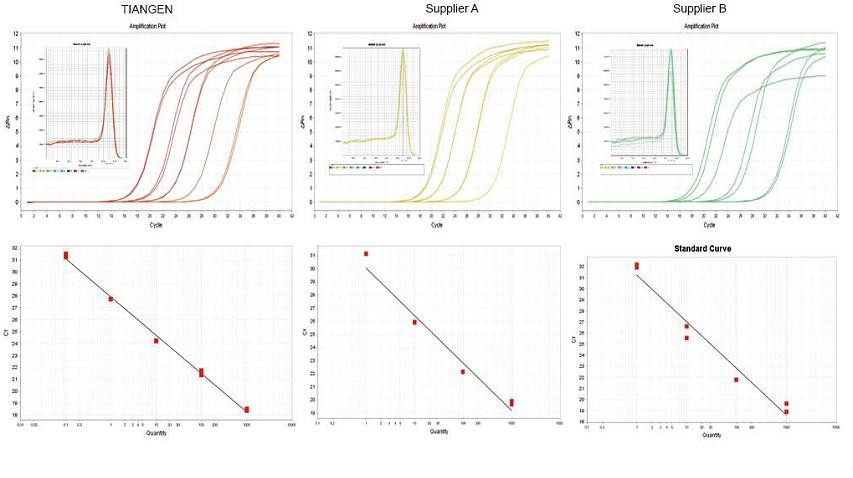 |
실험예 1. cDNA는 공급자 A 및 공급자 B의 관련 제품인 TIANGEN FastKing gDNA Dispelling RT SuperMix의 1단계 역 정량 시약을 사용하여 합성되었습니다. TIANGEN Talent qPCR PreMix(SYBR Green)를 이용하여 마우스의 RN5 유전자를 검출하고, 증폭 곡선, 용융 곡선 및 표준 곡선을 분석했습니다. 결과는 TIANGEN FastKing gDNA Dispelling RT SuperMix가 역전사 후 가장 높은 정량적 Ct 값과 우수한 내응력성을 가지며 불순물 잔류물이 높은 템플릿에 대해 분명한 이점이 있음을 보여줍니다. |
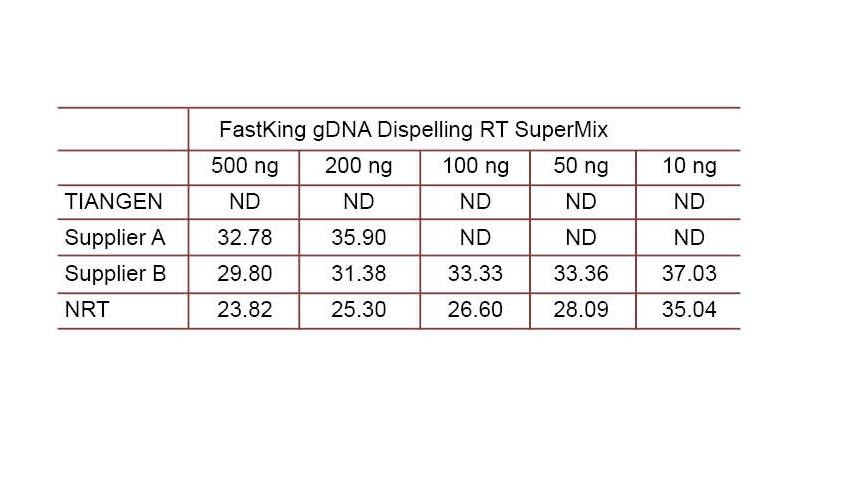 |
실험예 2. cDNA는 공급자 A 및 공급자 B의 관련 제품인 TIANGEN FastKing gDNA Dispelling RT SuperMix의 1단계 역 정량 시약을 사용하여 합성되었습니다. TIANGEN Talent qPCR PreMix(SYBR Green)를 사용하여 인간 HsG 유전자를 검출하고 다양한 농도의 게놈 DNA를 수동으로 추가하여 다양한 시약의 gDNA 제거 능력을 검출합니다. CT 결과는 TIANGEN FastKing gDNA Dispelling RT SuperMix가 게놈 DNA를 제거하는 탁월한 능력을 가지고 있음을 보여줍니다. 결과에 영향을 주지 않고 최대 500ng의 genomic DNA 잔류물을 완벽하게 제거할 수 있습니다. ND: 감지되지 않음. NRT: 역전사 없이 믹스 검출. |
A-1 RNA가 분해됨
——오염 없이 고품질 RNA를 정제합니다. RNA가 추출되는 재료는 RNA 분해를 방지하기 위해 가능한 한 신선해야 합니다. RT 반응 전에 변성 겔에서 RNA 무결성을 분석합니다. RNA 추출 후 100% 포름아미드에 보관해야 합니다. RNase 억제제를 사용하는 경우 가열 온도는 <45°C, pH는 8.0 미만이어야 합니다. 그렇지 않으면 억제제가 결합된 모든 RNase를 방출합니다. 또한 RNase 억제제는 ≥ 0.8mM DTT를 포함하는 용액에 추가해야 합니다.
A-2 RNA에는 역전사 반응 억제제가 포함되어 있습니다.
——역전사 억제제에는 SDS, EDTA, 글리세롤, 피로인산나트륨, 스페르미딘, 포름아미드, 구아니딘염 등이 있습니다. 대조 RNA를 검체와 혼합하고 대조 RNA 반응과 수율을 비교하여 억제제가 있는지 확인합니다. 억제제를 제거하기 위해 70%(v/v) 에탄올로 RNA 침전을 세척합니다.
A-3 cDNA의 첫 번째 가닥 합성에 사용되는 프라이머의 불충분한 풀림
——어닐링 온도가 실험에 사용된 프라이머에 적합한지 결정합니다. 임의 6량체의 경우 반응 온도에 도달하기 전에 10분 동안 25°C에서 온도를 유지하는 것이 좋습니다. 유전자 특이적 프라이머(GSP)의 경우 다른 GSP를 시도하거나 올리고(dT) 또는 무작위 헥사머로 전환하십시오.
A-4 소량의 시작 RNA
——RNA의 양을 늘립니다. 50ng 미만의 RNA 샘플의 경우 첫 번째 가닥 cDNA 합성에 0.1μg ~ 0.5μg 아세틸 BSA를 사용할 수 있습니다.
A-5 분석된 조직에서 target sequence가 발현되지 않습니다.
——다른 티슈를 사용해 보십시오.
A-6 PCR 반응 실패
——2단계 RT-PCR의 경우, PCR 단계의 cDNA 템플릿은 반응 부피의 1/5을 초과할 수 없습니다.
A-1 프라이머 및 템플릿의 비특이적 어닐링
——프라이머의 3'-말단은 2-3 dG 또는 dC를 포함하지 않아야 합니다. 첫 번째 가닥 합성 시 무작위 프라이머나 올리고(dT) 대신 유전자 특이적 프라이머를 사용하십시오. 처음 몇 사이클에서는 더 높은 어닐링 온도를 사용하고 그 다음에는 더 낮은 어닐링 온도를 사용하십시오. 반응의 특이성을 향상시키기 위해 PCR에 핫스타트 Taq DNA 중합효소를 사용합니다.
A-2 유전자 특이적 프라이머의 잘못된 디자인
——증폭 프라이머 디자인에 대해 동일한 원칙을 따릅니다.
게놈 DNA로 오염된 A-3 RNA
—— PCR 등급 DNase I로 RNA를 처리합니다. DNA 오염을 감지하기 위해 역전사 없이 대조 반응을 설정합니다.
A-4 프라이머 다이머의 형성
——3' 말단에 상보적인 서열이 없는 프라이머를 디자인합니다.
A-5 너무 높은 Mg2+ 집중
——마그네슘 최적화2+ 각 템플릿 및 프라이머 조합에 대한 농도
A-6 외래 DNA 오염
——에어로졸 방지 팁과 UDG 효소를 사용하십시오.
A-1 첫 번째 가닥 제품의 함량이 너무 높습니다.
——기존 PCR 반응 단계에서 첫 번째 가닥 생성물의 양을 줄입니다.
A-2 PCR 반응에서 너무 많은 프라이머 양이
——프라이머 입력을 줄입니다.
A-3 주기가 너무 많습니다.
——PCR 반응 조건을 최적화하고 PCR 주기 수를 줄입니다.
A-4 너무 낮은 어닐링 온도
—— 비특이적 개시 및 확장을 방지하기 위해 어닐링 온도를 높입니다.
A-5 DNA의 DNase 분해에 의해 생성된 올리고뉴클레오티드 단편의 비특이적 증폭 ——DNA 오염을 방지하기 위해 고품질 RNA를 추출합니다.
RT-PCR은 RNA를 cDNA로 역전사한 후 역전사된 cDNA를 PCR 반응의 주형으로 사용하여 표적 단편을 증폭시키는 것입니다. 실험의 특정 조건에 따라 무작위 프라이머, Oligo dT 및 유전자 특이적 프라이머를 선택합니다. 위의 모든 프라이머는 헤어핀 구조가 없는 짧은 진핵 세포 mRNA에 사용할 수 있습니다.
Random primer: hairpin 구조의 long RNA 뿐만 아니라 rRNA, mRNA, tRNA 등 모든 종류의 RNA에 적합합니다. 주로 단일 template의 RT-PCR 반응에 사용됩니다.
Oligo dT: PolyA 꼬리가 있는 RNA에 적합합니다(원핵생물 RNA, 진핵생물 Oligo dT rRNA 및 tRNA에는 PolyA 꼬리가 없음). Oligo dT는 PolyA tail에 결합되어 있기 때문에 RNA 시료의 품질이 높아야 하며, 소량의 분해라도 full-length cDNA 합성량을 크게 감소시킵니다.
유전자 특이적 프라이머: 주형 서열에 상보적이며 표적 서열이 알려진 상황에 적합합니다.
두 가지 방법이 있습니다.
1. 내부 참조 방법: 이론상 cDNA는 길이가 다른 DNA 단편이므로 전기 영동의 결과는 도말입니다. RNA 풍부도가 낮으면 전기영동에서 생성물이 나타나지 않지만 이것이 PCR에 의해 생성물이 증폭되지 않는다는 것을 의미하지는 않습니다. 일반적으로 내부 참조를 사용하여 cDNA를 검출할 수 있습니다. 내부 참조 결과가 있으면 기본적으로 cDNA의 품질을 보장할 수 있습니다(경우에 따라 대상 유전자 단편이 너무 길면 예외가 있을 수 있음).
2. 이 템플릿으로 증폭된 알려진 유전자가 있는 경우 해당 유전자의 프라이머로 확인할 수 있습니다. 내부 참조의 증폭이 반드시 cDNA에 문제가 없다는 것을 의미하지는 않습니다. Internal reference는 cDNA가 풍부하여 증폭이 용이합니다. cDNA가 여러 가지 이유로 부분적으로 분해되는 경우 확률의 관점에서 저존도 target 유전자의 PCR 결과에 큰 영향을 미칩니다. 내부 참조는 여전히 풍부하지만 증폭은 영향을 받지 않을 것입니다.
RNA를 부분적으로 분해합니다. RNA 무결성 검출 및 정제
종의 RNA 함량은 다를 수 있지만 일반적으로 추출된 총 RNA는 겔 전기영동에서 두 개의 명확한 28S 및 18S 밴드를 포함해야 하며 전자 밴드의 밝기는 후자의 밝기보다 2배 높아야 합니다. 5S 밴드는 RNA가 분해되었음을 나타내며, 그 밝기는 분해 정도에 비례합니다. 내부 참조의 성공적인 증폭은 RNA에 문제가 없다는 것을 의미하지 않습니다. 내부 참조가 풍부하기 때문에 분해가 심하지 않은 한 RNA는 증폭될 수 있습니다. OD260/OD280분광광도계로 측정한 순수 RNA의 비율은 1.9에서 2.1 사이여야 합니다. RNA에 있는 소량의 단백질 불순물은 비율을 감소시킵니다. 값이 너무 낮지 않은 한 RT는 영향을 받지 않습니다. RT에서 가장 중요한 것은 RNA 무결성입니다.
내부 참조 유전자의 확장은 RT가 성공했음을 나타낼 수 있지만 반드시 cDNA 가닥의 품질과 관련이 있는 것은 아닙니다. 내부 참조 단편은 일반적으로 크기가 작고 발현이 높기 때문에 역전사에 성공하기 쉽습니다. 그러나 표적 유전자의 크기와 발현은 유전자마다 다릅니다. cDNA 품질은 특히 2kb보다 긴 표적 단편의 경우 내부 참조로만 판단할 수 없습니다.
일부 샘플은 2차 구조가 복잡하거나 GC 함량이 풍부하거나 풍부하지 않아 귀중합니다. 이 경우 표적 단편과 시료의 크기에 따라 적절한 역전사효소를 선택해야 한다. GC 함량이 높고 2차 구조가 복잡한 RNA 템플릿의 경우 낮은 온도에서 또는 일반적인 역전사 효소로 2차 구조를 열기가 어렵습니다. 이러한 템플릿의 경우 Quant Reverse Transcriptase를 선택할 수 있습니다. 역전사 성능이 다양한 RNA 템플릿을 효율적으로 역전사하고 RNA를 cDNA 첫 번째 가닥으로 최대한 전사할 수 있는 M-MLV 시리즈 역전사 효소보다 역전사 성능이 분명히 우수하기 때문입니다. 일반 역전사 효소 키트를 사용할 경우 20μl 시스템은 1μg의 총 RNA만 효과적으로 역전사할 수 있습니다. 키트의 최대 RT 용량에 주의하십시오. 템플릿이 과도하게 추가되면 역전사에 의해 풍부한 RNA가 선호됩니다. 따라서 시스템의 최대 용량을 초과하지 않는 것이 좋습니다.
A-1 RNA가 심하게 분해되었는지, RT가 성공했는지 확인
일반적으로 내부 참조 증폭의 실패 원인은 심각한 RNA 분해에 의해 발생하는 경우가 많습니다. 또 다른 가능한 이유는 역전사 실패입니다. 내부 참조는 cDNA 단일 가닥의 품질을 판단하는 기준으로 사용할 수 없지만 RNA 품질에 문제가 없는 경우 역전사 성공 여부를 판단하는 기준으로 사용할 수 있습니다. 역전사 과정에서 가장 중요한 것은 반응 효율을 높이기 위해 일정한 온도와 일정한 반응계를 유지하는 것입니다.
A-2 내부 참조 유전자 증폭을 위한 프라이머의 신뢰성과 PCR에 사용되는 시약에 문제가 있는지 확인합니다.
상대 정량화의 경우 RNA는 역전사 전에 정량화되어야 하며, 이는 많은 역전사 키트에도 필요합니다(예: RNA 입력을 1μg로 정량화). 역전사된 cDNA는 RNA, oligo dT, enzyme, dNTP 및 약간의 DNA 잔기가 포함된 혼합 용액이기 때문에 편차가 발생하여 정확한 cDNA 정량이 불가능합니다. 따라서 RNA 정량화가 필요합니다. 역전사 효율이 서로 다른 샘플들 사이에서 동일하다는 점을 고려할 때, 수득되는 cDNA의 양은 동일해야 하며, 정량적 분석은 동일한 양의 total RNA에서 서로 다른 유전자의 발현 수준의 비교를 보여줄 수 있다. 상대 형광 정량 PCR을 수행할 때 내부 참조 유전자가 참조로 작용할 수 있으므로 역전사 후 정량 cDNA가 필요하지 않을 수 있습니다.
그것은 주로 유전자와 관련이 있으며 긴 단편의 역전사는 대부분의 유전자에서 실현 가능하지 않습니다. 첫째, 역전사 효율이 PCR보다 훨씬 낮다. 둘째, 많은 유전자의 GC가 풍부한 영역과 이차 구조는 역전사 및 PCR을 모두 제한합니다. 마지막으로 PCR의 충실도와 증폭 효율을 동시에 보장하기 어렵다. 역전사 과정에서, 특히 oligo dT를 사용하여 복제량이 적은 유전자에 대해 긴 단편을 얻을 수 있다고 보장할 수 있는 사람은 아무도 없습니다. GC가 더 많은 5' UTR은 훨씬 더 어렵습니다. 따라서 무작위 프라이머로 역전사하고, 표적 단편에서 자연 절단 부위를 찾고, 세그먼트로 증폭한 다음, 제한 분해 및 결찰을 수행하는 것이 여전히 합리적인 방법입니다. 일반적으로 2kb보다 큰 fragment를 직접 증폭하는 것은 어렵지만 항상 불가능한 것은 아닙니다. 2.M-MLV RT-PCR 키트를 직접 사용할 수 있습니다. 증폭 과정에서 어닐링 시간을 늘리고 사이클 수를 적절하게 늘립니다. 또는 중첩된 PCR을 적용하거나 정상적인 PCR 증폭 전에 적절하게 확장된 변성 및 확장 시간으로 하나 또는 두 개의 반응을 먼저 수행할 수 있으며, 이는 단편을 확장하는 데 도움이 될 수 있습니다. 중합효소의 충실도에 주의하십시오. 3.Long Taq는 이상적인 결과를 얻기 위해 PCR에 사용할 수 있습니다. 4. 단백질 발현 적용을 위해서는 high fidelity polymerase가 적용되어야 합니다.
TIANGEN에서 제공하는 역전사효소에는 Quant/King RTase와 TIANScript M-MLV의 두 가지 종류가 있습니다. 이들의 주요 차이점은 템플릿의 입력량입니다. Quant는 Moloney murine 백혈병 바이러스에서 파생된 일반적으로 사용되는 M-MLV와 다른 고유한 역전사효소입니다. Quant는 대장균을 조작하여 재조합적으로 발현되는 새로운 고효율 역전사효소입니다. Quant는 높은 역전사 활성과 높은 수율로 50ng-2μg의 RNA를 증폭하는 데 적합합니다. 일반 MMLV나 AMV에 비해 Quant의 가장 큰 특징은 RNA template과의 친화력이 매우 강하고 고온 변성 없이 transcript complex template을 역전시킬 수 있다는 점입니다. GC 함량이 높은 템플릿의 경우 역효율이 더 높습니다. 그러나 이 역전사효소에는 RNase H 활성이 있어 cDNA 산물의 길이에 영향을 미칠 수 있습니다(<4.5kb 템플릿에 적합). 기존의 역전사에는 TIANScript MMLV 역전사 효소가 권장됩니다. 이 RTase는 RNase H 활성이 매우 약한 변형된 효소로 long(> 5kb) cDNA 합성에 적합합니다.
원스텝 역전사 및 PCR 증폭은 cDNA 합성과 증폭 사이에 tube 덮개를 열지 않고 동일한 tube에서 완료되므로 오염을 줄이는 데 도움이 됩니다. 얻은 모든 cDNA 샘플을 증폭에 사용하기 때문에 민감도가 더 높아 최소 0.01pg의 총 RNA가 있습니다. 성공적인 1단계 RTPCR의 경우 일반적으로 유전자 특이적 프라이머를 사용하여 cDNA 합성을 시작합니다. 2단계 방법, 즉 역전사 및 PCR 증폭은 2단계로 수행됩니다. 먼저 RNA 주형에서 역전사를 수행하여 cDNA를 얻고, 얻은 cDNA에 하나 이상의 다른 PCR 반응을 수행합니다. 2단계 방법은 올리고(dT) 또는 무작위 프라이머를 사용하여 cDNA의 첫 번째 가닥 합성을 안내하고 특정 샘플의 모든 mRNA 정보를 역전사할 수 있습니다.
제품 카테고리
왜 우리를 선택 했습니까
저희 공장은 설립 이래
품질 우선. 당사의 제품은 업계에서 우수한 평판을 얻었으며 신규 및 기존 고객 사이에서 가치 있는 신뢰를 얻었습니다.